Kén - az
KÉN
S (kén),
nemfémes kémiai elem, családtag kalkogén (O, S, Se, Te és Po) - IVA a periódusos táblázat az alcsoport rendszer. Cera, valamint számos alkalmazás esetében ismert, ősidők óta. Lavoisier azt állította, hogy a kén - egy elem. Kén létfontosságú a növények növekedését és az állatok, ez egy része az élő szervezetek és azok bomlástermékei, a sok, például a tojás, káposzta, torma, fokhagyma, mustár, hagyma, szőr, gyapjú, stb Ugyancsak jelen a szén és az olaj.
Alkalmazás. Mintegy fele az éves fogyasztás kén a termelés ipari vegyi anyagok, mint a kénsav, kén-dioxid és szén-diszulfid (szén-diszulfid). Ezen túlmenően, a kén széles körben használják gyártásához inszekticidek, gyufák, műtrágyák, robbanóanyagok, papír, polimerek, festékek és színezékek a gumi vulkanizálás. Vezető pozícióját a kéngyártás az Egyesült Államok, a FÁK-országok és Kanada.
Az előfordulási jellegű. Kén található szabad állapotban (kénköves). Továbbá, vannak hatalmas tartalékok kén-szulfid ércek, különösen ércek ólom (galenit), a cink (cink cinkféle), réz (réz Sheen) és vas (pirit). Amikor eltávolítja a fémet a ércek általában megszabadítjuk kén jelenlétében oxigén tüzelés, ezáltal egy kén-dioxid (IV), amely gyakran a légkörbe kibocsátott felhasználás nélkül. Szintén nagyon sok szulfid ércek kén találtam-szulfát, például kalcium-szulfátot (gipsz), bárium-szulfát (barit). A tengervíz és sok ásványvizek jelen a vízben oldható magnézium- és nátrium-szulfát. Egyes ásványvizek történik a hidrogén-szulfid (hidrogén-szulfid). Az iparban, a kén lehet előállítani, mint melléktermék a kohászat folyamatokban, kokszolókemencék, a finomítás, a természetes vagy a füstgázokból. Természetes felszín alatti kén-kivonat, megolvasztjuk, és leadják a túlhevített víz a felszínre sűrített levegővel és a szivattyúk. A Frasch-folyamat helyreállítási kén kéntartalmú betétek a telepítési formájában koncentrikus cső G.Frashem szabadalmaztatott 1891, kapott kén tisztasága 99,5%.
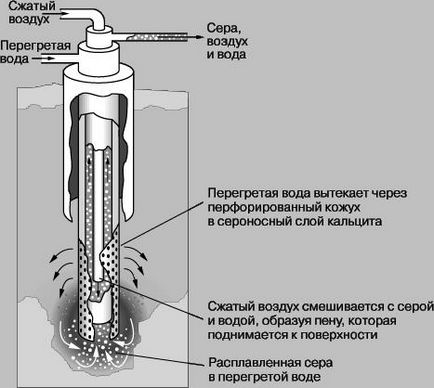
Frasch folyamat kivonat természetes kén a földalatti betétek.
Tulajdonságok. Kén formájában sárga, kristályos por vagy rideg tömege szagtalan és íztelen, és vízben oldhatatlan. Kén jellemezve, hogy több allotropic módosításokkal. A legismertebb a következők: kristályos kén - rombos (brimstone, a-S) és a monoklin (prizmatikus kén, b-S); amorf - kolloid (kén tej) és műanyag; közbenső amorf-kristályos - szublimált (virágok kén). KÉN tulajdonságok
Atomic száma 16 Atomtömeg 32066 Izotóp
stabil 32, 33, 34, 36
instabil 31, 35, 37
A legtöbb kapott sav előállítására használják műtrágyák (szuperfoszfát, ammónium-szulfát). A kénsav a kiindulási anyag előállításánál sók és egyéb savak szintézisében szerves anyagok, szintetikus szálak, tisztítására kerozin, petróleum olajok, a benzol, tolouola, a festékek gyártásához, maratása színesfémek, urán-hidrometallurgiai és néhány nem vastartalmú fémek, mosására és gyógyszerek, mint egy elektrolit ólomakkumulátorok és mint szárítóanyag. H2S2O3 tiokénsavval, kénsavval szerkezetileg analóg, kivéve a helyettesítő egy oxigén egy kénatomon. A legfontosabb-származék nátrium-tioszulfát Na2S2O3 - színtelen kristályok során képződött forró Na2SO3 nátrium-szulfit-ként színét. Thiosulfate (vagy hypo) nátrium használt fényképészeti fixáló (fixáló). Sulfonal (CH3) 2C (SO2C2H5) 2 - fehér, kristályos, szilárd anyag, szagtalan, halványan oldódik vízben, olyan gyógyszer, és használják, mint egy nyugtató és altató. A hidrogén-szulfid H2S (hidrogén-szulfid) - színtelen gáz, szúrós kellemetlen szagú rothadt tojás. Ez valamivel nehezebb a levegőnél (sűrűsége 1,189 g / dm3), könnyen cseppfolyósított egy színtelen folyadék, és könnyen oldódik vízben. A vizes oldat gyenge sav pH SERA 4. cseppfolyós hidrogén-szulfidot használunk oldószerként. Az oldat és a gáz széles körben használják a kvalitatív analitikai elválasztására és meghatározására számos fém. Légzés kis mennyiségű hidrogén-szulfid okoz fejfájást és émelygést, nagy mennyiségben, vagy a folyamatos belégzés hidrogén-szulfid okozhat bénulást az idegrendszer, a szív és a tüdő. Bénulás hirtelen következik be, ennek eredményeként a megsértése életfunkciók. A kén-monoklorid, S2Cl2 - füstölgő borostyánszínű olajos folyadék, szúrós szagú, könnyezést és akadályozza a légzést. Ő füstök nedves levegő és a víz hatására elbomlik, de oldódik szén-diszulfidot. A kén-monoklorid - jó oldószer kén, jód, fém-halogenidek és szerves vegyületek. Monokloridot alkalmazunk a vulkanizálás gumi gyártása során tinta és inszekticidek. A reakció után az etilénnel előállított illékony folyadék, úgynevezett mustárgáz (ClC2H4) 2S - toxikus vegyületet használni, mint egy harci kémiai irritáló. Szén-diszulfidot CS2 (szén-diszulfid) - halványsárga folyadék, mérgező és tűzveszélyes. CS2 kapott szintézisét az elemek elektromos kemencében. Az anyag vízben oldhatatlan, egy nagy törésmutatójú, nagy gőznyomású, alacsony forráspontú (46 ° C). Szén-diszulfid - hatásos oldószer a zsírt, olajat, gumi és a gumi - széles körben használják a kitermelés az olajok a termelés mesterséges selyem, lakk, gumi ragasztók és mérkőzések, megsemmisítése magtár zsizsikek, molyok és ruházati, hogy fertőtlenítse a talajt. Lásd. Szintén a kémiai elemek.
IRODALOM
sernokislotchika Directory. M. 1971 Busev AI Simon L. Analitikai kémia kén. M. 1975