Szervezeti szintek fehérjemolekulák
A natív, állapot (olyan állapot, amelyben a fehérjék végre a biológiai funkciójuk) fehérje-molekula egy jellegzetes térszerkezetét érte (konformáció).
Attól függően, hogy a konformáció, azaz polipeptidlánc karakter helye a térben, vagy más szóval, az alak a molekulák, fehérjék osztható két nagy csoportra -fibrillyarnye és globuláris. Polipeptid lánc fibrilláris proteinek egymással párhuzamosan ugyanazon tengely mentén, alkotó hosszú rostos szál - fibrillumok. Ezek a fő szerkezeti elemeinek kötőszövet és csontszövet, a kollagén, az inak, kürt képződmények, bőr, köröm, toll, szőr. Ez a stabil anyagok, amelyek oldhatatlanok vízben és híg oldatokban.
Globuláris fehérjék jellemző a gömb alakú vagy gömbszerű szerkezetével, polipeptid-láncok hajtogatva egy kompakt formáció emlékeztető a labda alakú (gömböcskéket). Az ilyen fehérjék a szervezetben sokkal hosszabb, mint a fibrilláris. Ezek közé tartozik majdnem minden jelenleg ismert enzimek és antitestek, néhány hormonok és proteinek, hogy hajtsa végre a közlekedési funkcióval (hemoglobin, szérum albumin, stb). A legtöbb globuláris fehérjék oldhatók vízben, és könnyen diffundál.
Egyes fehérjék köztitermék. A fibrilláris, tartalmaznak, szálas szerkezetét, ugyanabban az időben, hasonló a globuláris fehérjék oldhatók vizes sóoldatok.
Annak jelzésére, a különböző szintű a fehérjemolekula szerkezetét olyan fogalmak a primer, szekunder, tercier és kvaterner struktúrák.
Elsődleges szerkezet jellemzi minőségi aminosav-összetételét a polipeptid-lánc, az aminosav-maradékokat az abban peptidkötésekkel kapcsolt, és a sorrendben egymás után ezen maradékok. Ez a szerkezet Sejteti forgalomba egy fehérjemolekula a síkban.
Azonban, az elsődleges fehérje szerkezete a tudás nem elég, hogy képviselje a teljes szerkezetet. Tény, hogy a fehérjemolekula nem fekszik egy síkban.
A másodlagos szerkezet - az alak a fehérje lánc, egy eljárás annak elhelyezése a térben - nagy mértékben határozza meg a környezeti feltételek, amelyben a fehérje és specifikus tulajdonságait és szerkezetét a peptid kötést.
Tanulás fibrilláris proteinek, R. L. Pauling és Corey beállította az alapvető paramétereket a peptidkötés, ahol jelezte, hogy a távolság a szénatommal és a nitrogénatommal (azaz hossza peptidkötések) van 0,132 nm. Ez az érték az átlagos értékek között a hossza egy hagyományos egyetlen C-C (0154 nm) és egy dupla> C = O (0,123 nm) kötések. Ennélfogva, a peptid-kötés hasonló jellegűek a dupla és szabadon forog a lehetetlenné. Négy peptidkötés atomok (O, C, N, H) és két # 945 szénatom található egy síkban, és az oxigén és a hidrogén atomok - a transz-helyzetben van a peptidkötés. Emellett azt is mért szög között az egyes atomok (ábra. 25).
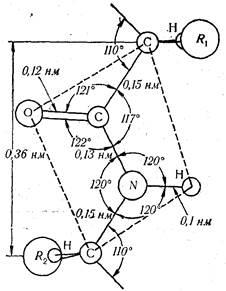
A kapott adatokat a peptidkötés szerkezete, R. L. Pauling és Corey modell beépített rövid peptidek, és arra a következtetésre jutott, hogy a polipeptid-lánc egy hosszú sor síkok, elválasztjuk # 945 szénatom, vagy metilén-hidak. Ebben a tekintetben, az elsődleges szerkezetét a fehérje molekula pontosabban képviseli például egy hosszú szénláncú, amely egy nagy számú síkok peptidkötéseket, melyek csatlakoznak a megfelelő aminosavak a gyökök bizonyos szögből.
Létrehozta a lehetőségét, hogy egy forgatás helyszínen Pauling és Corey jött egy másik fontos következtetés - a legegyszerűbb térszerkezete a peptid lánc egy spirál. A szerkezet elemzi # 945; hélix és jellegzetes # 945; -keratinov periodikusan ismétlődő egység egy tekercset (ábra. 26). Tart a tengely mentén körülbelül 0,54 nm, és egy hosszú ideig az úgynevezett hélix. Egy fordulatot 3,6 aminosavat. Az egyik ilyen maradékot foglal 0,15 nm, és a jelentése egy kis idő # 945; spirál. ezt # 945-helikális struktúra a peptid-lánc kialakulását teszi lehetővé, láncon belüli hidrogénkötések menetei között a hélix. Azt találtuk, hogy azok között kialakított hidrogénatomok kötődik egy elektronegatív nitrogénatomjához egy peptid kötést, és oxigénatom negyedik maradékot karbonil-csoport. Ezen túlmenően, minden egyes peptid-kötés lánc részt vesz a kialakulását a hidrogén kötések (az első, a negyedik, a második, hogy az ötödik, a harmadik, hogy a hatodik, és így tovább), úgy, hogy az egész rendszer, amennyire csak lehetséges, a teljes ezen kötvények.
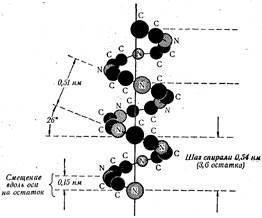
Vannak még más módon a csomagolási helikális peptid láncok, de # 945-helikális konfigurációt a legstabilabb. Azt feltételezik, hogy egy ilyen alak peptidláncokat hogy önkényes, hiszen a legkevésbé szabad energia.
Ma már köztudott, hogy a rostos proteinek kapcsolatos # 945; -keratinam (szőr, gyapjú, szarv kialakulását, körmök, a bőr, tollak, stb), ez áll egy párhuzamos peptid láncok, amelyek # 945; helikális konfigurációval. Hangsúlyozni kell, hogy a kötelezettségvállalás a kialakulását stabil # 945; hélixet természete határozza meg, és a szekvencia aminosav gyököket a láncon, és a pH függvénye.
Kutatásnak és egy másik formája a peptid lánc elhelyezése a térben. A megnevezett # 946 konformációját és van egy hosszúkás cikk-cakk alakú (27. ábra). Fentiekkel párhuzamosan helyezkedik el a lánc # 946; -conformation, vannak összekapcsolva, keresztirányú láncok közötti hidrogénkötések és kialakítjuk a rétegezett-redős struktúrát. A térhálósodás, valamint a # 945; hélix, magában foglalja az összes peptidkötéseket, ezáltal növeli a szerkezet nagy stabilitást. típusú hajtogatott réteg szerkezete hasonlít egy kifeszített # 945; hélix és jellemző fehérjék # 946; -keratinov. Egy példa egy ilyen fehérje lehet fibroin fonalat, amely áll selyem.
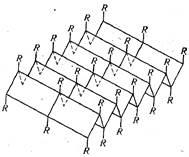
Ily módon a szekunder szerkezete a fehérjemolekula - peptid láncot ilyen konfigurációban egy olyan térben, amely egy spirál alakú, vagy egy réteges-redős struktúrát. A szekunder struktúra legmagasabb formája a szervezet fibrilláris proteinek.
Spirális vagy másodlagos fehérje szerkezetét különbözőképpen lehet elhelyezni egy bizonyos térfogatú. Eljárás szóló, egy másodlagos szerkezet kialakulásának tekercsek különböző formájú nevezzük harmadlagos szerkezetet. Ezt a magasabb szintű szervezet a fehérje molekulák jellemző globuláris fehérjéket. Harmadlagos szerkezete meglehetősen bonyolult, és a tanulmány bemutatja bizonyos nehézségek. Jelenleg ezért, ez a szerkezet már jól tanulmányozott néhány fehérjénél.
Jelentős szerepet kialakulását tercier struktúrák játszanak hidrogén és diszulfid-kötések, hozzájárulva annak létrehozásához, valamint a rendelkezésre álló helyi instabil pontok helyzete, ahol # 945; spirál lehet hajlítani. Mint általában, a helyeken a peptidlánc kanyarok prolinmaradékokra találhatók, valamint aminosavak, amelyek nem képesek könnyen képeznek # 945-helikális szerkezetet, mint például izoleucin vagy sorozatban, és az aminosav-oldalláncok, amelyek pH = 7 egyenlő díjakat. Gyökök, savak, nyomja szét sérti spiralizációját lánc miért ezeken a helyeken peptid lánc könnyen meghajlik. Úgy tartják, hogy a harmadlagos szerkezete automatikusan történik, mint kölcsönhatás eredményeként az aminosavmaradékok oldószer-molekulákkal. Így hidrofób gyökök „húzott” a fehérjemolekula, és a hidrofil csoportok felé az oldószert. Ezáltal egy kompakt fehérjemolekula képződnek, amelyeken belül a vizet lényegében nem molekulák. Ez vezet létrehozását energetikailag kedvező konformációja a fehérjemolekula.
Egy jól tanulmányozott fehérje háromdimenziós szerkezet myoglobin. Végzett vizsgálatok J. Kendrew és munkatársai kimutatták, hogy a mioglobin molekula olyan egyetlen peptidlánc, csavart egy spirál. Azokon a helyeken, kanyarok, ahol a spirál hiányzik, akkor prolin. A peptidlánc mioglobin, mint egy hosszú, bizarr „kolbász” (ábra. 28). Egy ilyen sajátos szerkezetét, eredő csavaró és hajlító, és az úgynevezett harmadlagos szerkezetének mioglobin.
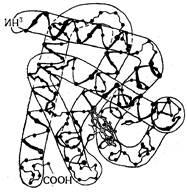
Egy még magasabb szintű szervezet a fehérje molekula egy kvaterner szerkezetet. Ez eredményeként keletkezik az egyesülési több peptid láncok, amelyek primer, szekunder és tercier szerkezetét. Más szóval, ez a szint a szervezet a unió több peptid láncokat a harmadlagos szerkezetének egy nagy molekula, (ábra. 29), ahol a molekulatömeg meghaladja az 50000 Az ilyen fehérjéket nevezzük oligomerek. Mindegyik peptid lánc, egy részét egy oligomer protein protomer ismert, amely egyesíti alkotnak alegységhez. Ez a kifejezés egy funkcionálisan aktív részét oligomer protein. Így a negyedleges szerkezet jellemző oligomer proteinek.
A klasszikus példa egy oligomer vagy egy olyan fehérje negyedleges szerkezet hemoglobin. A fehérje része a molekulák, úgynevezett globin promoterok áll 4-2 azonos # 945; -lánca és két azonos # 946; -lánca; # 945; - és # 946; - lánc kapcsolódási párokba formájában két pár alegységet, amely disszociál hemoglobin molekula (30. ábra).
Ábra. 30. Az áramkör hemoglobin molekula disszociációs két alegységre.
Így, a hemoglobin molekula áll négy peptid láncok, amelyek szorosan összecsomagolt és alkotnak egy globuláris szerkezetet. Között az egyedi láncok erős kovalens kötés, mégis az egész molekula nagy stabilitású.
Azt találtuk, hogy a tercier struktúráját # 945; - és # 946; -lánc nagyon hasonló a tercier konfigurációja egyetlen mioglobin láncot. Ez azt sugallja, hogy egy hasonló biológiai funkciója a két fehérje, hogy képesek reverzibilisen megkötik az oxigént, hasonlósága miatt azok harmadlagos szerkezetének a peptid láncok. Összefoglalva hangsúlyozni kell, újra, hogy a szekunder, tercier és kvaterner szerkezete fehérjemolekulák által meghatározott aminosav-szekvencia a peptid-lánc, azaz, elsődleges szerkezete. Ezen túlmenően, a peptid lánc konfigurációban is meghatározzák a mérete, alakja és aminosav-R-csoportok elrendezése érdekében.
Minden egyes fehérjét jellemezve, hogy legalább egy háromdimenziós szerkezet, amely stabil, és biológiai aktivitást mutat fiziológiás körülmények között (hőmérséklet, pH). Ez a szerkezet az úgynevezett natív konformáció a fehérje.