Elpárologtatása folyadékok - studopediya
Égés folyadékok jellemzi két egymással összefüggő jelenségek - párolgás és égési gőz-levegő keverék a folyadék felszíne feletti. Ezért, az égési folyadékok kíséretében nemcsak a kémiai reakció (oxidációs halad át lángoló égés), hanem a fizikai jelenségek (párolgás és a formáció a folyadék felszíne feletti a gőz-levegő keverék), amely nélkül égés nem lehetséges.
Az átmenet a folyadék egy gőz nevezzük Gőzképződés. Két az eljárási formák: párolgás és Ki-ének. Bepárlás - az átmenet a folyadék gőzzé szabad a folyadék felszíne alatti hőmérsékleten a forráspontja (lásd 4.1 ábrát ..). Bepárlás miatt előfordul, hogy a termikus mozgás a folyadék molekulák. A mozgás sebessége mol-molekulák széles skálán mozog, erősen támaszkodva mindkét oldalán a középérték. Része molekulák egy kellően nagy kinetikus energia, a folyadék szünetek távol a felületi rétegben a gáz (levegő) környezetben. A többlet energia vész kárba zsidó-csont molekulák fordított leküzdésére az erők köl - közötti kölcsönhatás a molekulák és a munka a tágulási (térfogat-növekedés), amikor elhaladnak folyadékpárolgási. Forráspont - a párolgás nem csak a felületről, hanem a folyadék térfogata a gőzképződés buborékok a teljes térfogatban, és izoláljuk őket. Bepárlás megfigyelt bármilyen hőmérsékleten folyadék. Forráspont csak akkor következik be, olyan hőmérsékleten, melyen a gőz nyomás eléri az érték a külső (légköri) nyomáson.
Mivel a Brown-mozgás a gáz zónában történik a fordított folyamat - kondenzáció. Ha egy zárt térfogatot a folyadék feletti, a folyadék bármilyen hőmérsékleten egy dinamikus egyensúly alakul ki a folyamatok lebegő és kondenzációs.
A gőz egyensúlyban van a folyékony, telített gőznek hívják. Egyensúlyi állapot megfelel egy bizonyos hőmérséklet egy adott gőz koncentrációját. A gőznyomás egyensúlyban van a folyadék, az úgynevezett gőznyomás.
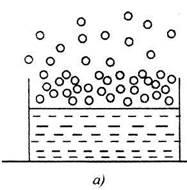
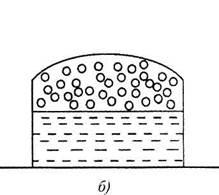
Ábra. 4.1. Vezetés a folyadék elpárolgása a: a) egy nyitott konténer, b) egy zárt edény
A telített gőz nyomása (rn.p.) adott folyadékban, egy állandó hőmérséklet konstans és változatlan érte. telített gőznyomása folyadék hőmérsékletét határozzuk meg: a hőmérséklet növekedésével a gőznyomás egyre etsya. Ez annak köszönhető, hogy a növekedés a kinetikus energia a molekulák egy folyadék a hőmérséklet növekedésével. Ugyanakkor a növekvő arányban molekulák kifejtő etsya elegendő energiával rendelkezik ahhoz, hogy mozgatni párban.
Így, mint a felület (tükör) vseg folyadék-gőz keveréket, és létezik olyan helyzetben egyenlő az egyensúlyi nyomású telített folyékony jellemezve gőz vagy koncentráció. Ahogy a hőmérséklet-nyomás telített gőz szerint növekszik Clapeyron-Clausius egyenlet:
vagy a szerves formában:
ahol rn.p. - telített gőz nyomása Pa;
DNisp - párolgási hője, a hőmennyiség szükséges átalakítani az elpárolgott folyadék egységnyi tömegére, kJ / mól;
T - a közeg hőmérsékletét, K.
A koncentráció a telített gőzök Snad folyadék felszíne összefügg annak nyomását arány:
(4.1 és 4.2), amely a hőmérséklet növelésével a folyadék gőznyomását (vagy koncentráció) exponenciálisan növekszik. Ebben az összefüggésben, ha egy bizonyos hőmérséklet felett van a folyadék felület képződött gőz koncentrációja megegyezik az alsó gyulladási határa. Ez a hőmérséklet az úgynevezett alsó hőmérsékleti határ a láng terjedésének (NTRP).
Ezért bármilyen folyadék mindig létezik egy hőmérséklet-tartományban, amelyben a con-központosítás a telített gőzök a tükör felett lesz egy gyújtási régióban, azaz. E. HKPRP £ £ VKPRP Jn.