Mi a fehérjemolekula
Az elsődleges szerkezetét a fehérje mennyiségét értjük és sorrendje váltakozásából aminosavak egymáshoz peptidkötésekkel a polipeptid-láncban.
A polipeptid-lánc egyik végén tartalmaz egy szabad, nem vesz részt a peptidkötés kialakítására, NH2 -csoport, ezt a részt az említett N-végén. A szemközti oldalon van egy szabad, nem vesz részt a kialakulását a peptid kötést, HOOC-csoport jelentése - C-terminális. Az elején a lánc megkapta az N-terminális, ez itt, hogy indul a számozás az aminosav:
A aminosavszekvenciája inzulin beállított F. Sanger (University of Cambridge). Ez a fehérje két polipeptid lánc. Az egyik lánc áll 21 aminosavból, másik lánc - a 30. láncok kapcsolódnak a két diszulfid híd (6. ábra).

Ábra. 6. elsődleges szerkezete humán inzulin
Az átirat ez a struktúra már töltött 10 év alatt (1944-1954 gg.). Jelenleg az elsődleges szerkezete számos fehérje határozza meg, a meghatározó folyamat automatizált, és nem jelent komoly problémát a kutatók számára.
Információ az elsődleges szerkezetének egyes fehérje kódolódik a gén (DNS rész) és végrehajtani a transzkripció során (az információ másolását a mRNS) és transzlációs (szintézisét a polipeptid-lánc). Ezzel kapcsolatban meg lehet megállapítani a primer szerkezetét a fehérje is egy ismert szerkezetű megfelelő gén.
Látható a taxonómiai kapcsolat típusok az elsődleges szerkezete homológ fehérjék. Homológ fehérjék közé tartoznak azok a fehérjék, amelyek a különböző típusú ugyanazt a funkciót. Az ilyen fehérjék hasonló aminosav-szekvenciákkal. Például, citokróm C fehérje legtöbb faj relatív molekulatömege körülbelül 12500 és körülbelül 100 aminosav. A különbség a primer szerkezetében citokróm c arányos kétféle filogenetikus különbséget ezen fajok között. Tehát ló citokróm c és élesztők különböznek 48 aminosavat, csirke és kacsa - két, a citokróm csirke és pulyka azonosak.
A másodlagos szerkezete egy fehérje által alkotott hidrogén kötések kialakulását közötti peptid csoportok. Két típusú szekunder struktúrákat: α-β-hélix struktúrát (vagy hajtogatott réteg). A fehérjék nem képező másodlagos szerkezet is jelen vannak részei a polipeptid lánc.
α-Helix alakú rugót. A formáció a α-hélix egyes oxigénatom a peptid-csoport képez hidrogén kötést hidrogénatom a negyedik lánc NH-csoportok:
Mindegyik spirál viszont össze van kapcsolva egy további többszörös spirális tekercset hidrogénkötések, amely a szerkezet jelentős erőt. a-hélix a következő tulajdonságokkal rendelkezik: az átmérője a hélix 0,5 nm, a pályán - 0,54 nm fordulatonként a hélix az 3,6 aminosavat (7. ábra).

Ábra. 7. modell-hélix, amely annak mennyiségi jellemzői
Aminosav oldalláncokon kifelé irányul a hélix (ábra. 8).

Ábra. 8. hélix modell, ami a térbeli elrendezése oldalláncok
A természetes L-aminosavak épülhet, mint a jobb oldali, bal oldali spirál. A legtöbb természetes fehérjék jellemző a jobb oldali spirál. D-aminosavak is lehet kialakítani, mint a bal és a jobb spirál. Ugyanaz polipeptidlánc, amely keverékéből D-és L-aminosav-maradék nem képesek alkotó a-hélix.
Egyes aminosavak képződésének megakadályozására α-hélix. Például, ha egy sorban az áramkörben több pozitív vagy negatív töltésű aminosavak, így része dönt a-helikális struktúrák miatt kölcsönös taszítása, mint töltésű gyökök. Akadályozása kialakulását gyökök hélix rendelkező aminosavmaradékok a nagy méretek. Akadályozza a kialakulását α-hélix, a jelenléte a polipeptid-lánc prolin aminosavak (ábra. 9). A prolin gyököt képező nitrogénatom peptidkötéssel egy másik aminosav, nincs hidrogénatom.
Ábra. 9. prolin maradék megakadályozza a hélix kialakulásához
Ezért a proiinmaradék része a polipeptid-lánc nem képes alkotó láncközi hidrogén kötést. Ezen túlmenően, a nitrogénatom a prolin része egy merev gyűrű, amely lehetetlenné teszi, hogy forogjon egy kommunikációs N - C és hélix kialakulását.
Leírunk α-hélix, és más típusú hélixek. Azonban azok ritkák, többnyire rövid távolságokon.
A hidrogén kötések kialakulását közötti peptid csoportok szomszédos polipeptid-lánc fragmenst képződését eredményezi a β-szerkezet vagy hajtogatott rétegek:

Ellentétben α-hélix hajtogatott réteg cikcakk alakú hasonló egy harmonika (ábra. 10).

Ábra. 10. A szerkezet a β-fehérje
Megkülönböztetése a parallel és antiparallel hajtogatott rétegek. A párhuzamos β-szerkezet van kialakítva a részek között a polipeptid-lánc, amelynek irányok egybeesnek:

Antiparalelnye β-struktúrák képződnek között ellentétes irányú régiói a polipeptid-lánc:
p-szerkezetek között kialakítható több mint két polipeptidlánc:
Részeként néhány fehérje másodlagos szerkezet ellátható csak α-hélix, a másik - csak a β-struktúrák (parallel vagy antiparallel, vagy mindkettő, és mások) a harmadik együtt α-spiralizált részek lehetnek jelen, és β-szerkezet.
Számos proteint vtorichnoorganizovannye szerkezete (α-hélix-szerkezetéből) hajtogatott egy bizonyos módon egy kompakt gömböcske. A térbeli szerveződésének globuláris fehérjék nevezik harmadlagos szerkezete. Így a harmadlagos szerkezet jellemzi a háromdimenziós elrendezése a polipeptid-lánc szakaszok térben. A formáció a harmadlagos szerkezet van szó ionos és hidrogén kötések, hidrofób kölcsönhatások, a van der Waals-erők. Stabilizálja a harmadlagos szerkezetét a diszulfid hidak.
A harmadlagos szerkezete fehérjék által meghatározott aminosav-szekvencia. Annak kialakulása kommunikációs előfordulhat közötti aminosavak a polipeptid-lánc található egy jelentős távolságra. Abban az oldható fehérjék poláros aminosav gyökök általában megjelennek a felületen a fehérjemolekulák és legalább - a molekulában, a hidrofób gyökök kompakt csomagolva belül gömböcske képező hidrofób régiót.
Jelenleg, a harmadlagos szerkezete számos fehérje telepítve. Vegyünk két példát.
Mioglobin - oxigén kötő fehérje relatív tömege 16700. A funkció - a tárolási oxigén az izmokban. A molekulában van egy polipeptidlánc, amely a 153 aminosavból és a hem, amely fontos szerepet játszik az oxigén kötési.
A térbeli szerveződésének mioglobin létre munkája révén Dzhona Kendryu és kollégái (11.). A molekulában a fehérje tartalmaz nyolc α-helikális régiók, amelyek 80% -át az összes aminosavat. Mioglobin molekula nagyon kompakt, hogy elfér belül összesen négy vízmolekulák, szinte az összes poláros gyökök az aminosavak találhatók a külső felületén a molekula, a legtöbb hidrofób gyökök a molekula a felszín közelében egy hem - nem-fehérje-csoport, kötéséért felelős az oxigén.

11. ábra. A harmadlagos szerkezete mioglobin
Ribonukleáz - globuláris fehérje. Ez kiválasztódik a sejtek a hasnyálmirigyben, ez - egy enzim, amely katalizálja a az RNS hasítását. Ellentétben mioglobin, ribonukleáz-molekulának a nagyon kevés α-helikális régiók és elegendően nagy számú szegmens, található β-konformációban. Tartóssága harmadlagos szerkezetét a fehérje diszulfid-kötések, így 4.
Számos proteint áll több, két vagy több fehérje alegységek, vagy olyan molekulák, amelyek egy konkrét másodlagos és harmadlagos szerkezet tartja össze hidrogénkötések és ionos kötések, hidrofób kölcsönhatások, a van der Waals-erők. Ez a szervezet a fehérje molekulák az úgynevezett kvaterner szerkezetét. és nevezett oligomer proteinek önmaguk. Egyedi alegységei vagy fehérjemolekula részeként egy oligomer nevű fehérje promoterok.
A száma protomerek oligomer fehérjék széles tartományban változhat. Például, a kreatin-kináz két protomerek hemoglobin - 4 promoterok, RNS-polimeráz az E. coli - felelős enzim az RNS, - 5 promoterok, piruvát-dehidrogenáz komplex - a 72 promoterok. Ha a fehérjét tevődik össze két protomerek, ez az úgynevezett dimer, négy - tetramer, hat - hexamer (12.). A legtöbb fehérje oligomer molekula tartalmaz 2 vagy 4 protomer. A kompozíció a oligomer fehérje tartalmazhatja ugyanazon vagy különböző promoterok. Ha egy része a fehérje protomer két azonos, ez - egy homodimer. ha eltérő - heterodimer.

Ábra. 12. oligomer proteinek
Tekintsük a szervezet hemoglobin molekula. A fő funkciója a hemoglobin az oxigén szállítása a tüdőből a szövetekbe, és a szén-dioxid a fordított irányban. A molekula (. 13. ábra) négy polipeptidláncot, két különböző típusú - a két α-láncból és két β-láncok és hem. A hemoglobin egy fehérje hasonlít a mioglobin. Másodlagos és harmadlagos szerkezetének a mioglobin és hemoglobin promoterok nagyon hasonló. Minden protomer tartalmazó hemoglobin, mioglobin, mint 8 α-spiralizált részek a polipeptid-lánc. Meg kell jegyezni, hogy az elsődleges szerkezetét mioglobin és hemoglobin protomer azonosak, ezért csak 24 aminosavat. Ezért a fehérjék, amelyek jelentősen eltérnek a primer szerkezetben is hasonló térbeli szerveződés és hasonló funkciókat látnak.
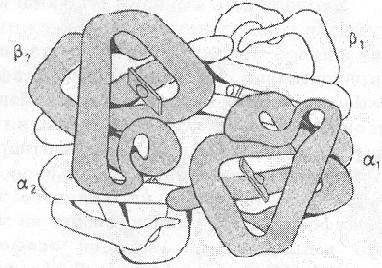
Ábra. 13. A szerkezet a hemoglobin